![]() 《初识酸和碱》测试
《初识酸和碱》测试
1、单选题(每小题只有一个正确答案)
1.不是碱的物质是( )
A.NH3·H2O B.Na2CO3 C.NaOH D.Fe(OH)3
2.柠檬酸是一种要紧的有机酸,又名枸橼酸,无臭,有非常强的酸味,易溶于水。其它的化学式是C6H7O8,关于柠檬酸的下列说法正确的是( )

A.柠檬酸中碳元素、氢元素、氧元素的个数比为6:7:8
B.每一个柠檬酸分子中质子数与中子数肯定相等
C.柠檬酸分子中含有21个原子核
D.柠檬酸能与铁锈反应,因而可以去除铁制水壶里的锈迹
3.小红同学梳理了以下常识:
①向某固体上滴加稀盐酸,有气泡产生,则该固体肯定是碳酸盐;
②铵态氮肥和熟石灰混合用,即能改良酸性土壤,又能增强肥效;
③在置换反应时,元素化合价必然会改变;
④生成盐和水的反应肯定是中和反应;
⑤“粗盐中难溶性杂质的去除”的实验中,当蒸发皿中出现较多量固体时,停止加热;
⑥某溶液中加入BaCl2溶液,产生白色沉淀,则该溶液中肯定含有SO42﹣。
其中正确的个数是( )
A.1个 B.2个 C.3个 D.4 个
4.下列有关熟石灰的说法错误的是
A.熟石灰的溶解度随温度升高而增大 B.熟石灰由生石灰与水反应而制得
C.熟石灰又称为消石灰 D.熟石灰可以用来改良酸性土壤
5.下图表示相连线的酸、碱、盐之间可以发生复分解反应,下表提供的四组物质符合下图需要的是()
物质 组别 | 酸 | 碱 | 盐1 | 盐2 |
A | H2SO4 | Ca(OH)2 | BaCl2 | Na2CO3 |
B | H2SO4 | Ca(OH)2 | Na2CO3 | BaCl2 |
C | HCl | NaOH | Na2CO3 | BaCl2 |
D | H2SO4 | Ba(OH)2 | Na2CO3 | CuSO4 |
A.A B.B C.C D.D
6.辨别下列各组物质时,若使用括号内的物质不可以区别的一组()
A.NaCl、NaOH、NH4NO3三种固体(水) B.NaOH、NaCl、Na2SO4三种溶液(酚酞)
C.铁粉、碳粉、氧化铜粉末(稀盐酸)D.K2CO3、Na2SO4、BaCl2三种溶液(稀硫酸)
7.下图是物质X溶于水中发生解离的微观示意图,其中能说明X是一种酸的是()
A. B.
B. C.
C. D.
D.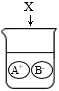
8.有一无焰野外加热器,由镁和水反应产生热量来进行加热,化学方程式为Mg+2H2O=Mg 2+H2↑。该反应是( )
A.化合反应 B.分解反应 C.复分解反应 D.置换反应
9.一些食物的pH范围如下,其中呈碱性的是( )
A.柠檬汁 B.番茄汁
C.牛奶 D.鸡蛋清
10.在日常,下列做法正确的是()
A.汽油能与油污发生化学反应,生成可溶于水的物质,从而除去衣物上的油污
B.为了保护树木,用含有硫磺粉等的石灰浆粉刷树干
C.炒菜时油锅中的油不慎失火,立即用水浇灭
D.医用酒精的水平分数为75%
11.逻辑推理是学好化学的要紧思维办法。以下推理正确的是( )
A.Na+、Cl-的最外层电子数均为8,则最外层电子数为8的粒子都是离子
B.酸在水溶液里肯定电离出氢离子,则电离出氢离子的肯定是酸
C.某物质在空气中燃烧生成水,所以该物质中肯定含有氢元素
D.溶液具备均一性和稳定性,所以具备均一性和稳定性的液体肯定是溶液
12.工业盐酸因含有FeCl3而显黄色,现向1—2ml工业盐酸中逐滴滴加NaOH溶液,其加入量与生成沉淀量的关系应是:
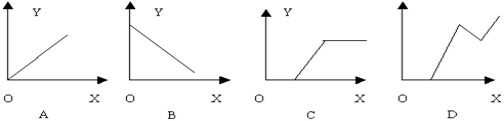
A.A B.B C.C D.D
13.下列离子能在pH=2的水溶液中很多共存的是
A.![]() B.
B.![]()
C.![]() D.
D.![]()
14.把适量氧化铜和0.8g氧化镁的混合物投入到溶质水平分数为9.8%的稀硫酸中,待固体完全溶解后,再往溶液里加入溶质水平分数为8%的NaOH溶液,生成沉淀水平与加入溶液水平关系如图所示。下列说法中正确的是

A.稀硫酸的水平为120 g B.a的取值范围为0< a<60
C.当a值为60时,b值为4.8 g D.混合物的水平可能为7.0 g
15.向某硫酸和硫酸铜的混合溶液中加入某浓度的氢氧化钠溶液,产生沉淀的水平与加入氢氧化钠溶液的水平关系如图所示,下列说法正确的是( )
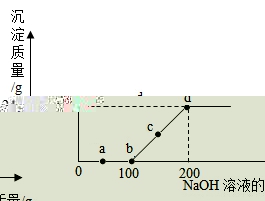
A.加入氢氧化钠溶液的溶质水平分数为20%
B.![]() 点溶液中含有两种溶质
点溶液中含有两种溶质
C.![]() 段发生的反应为中和反应
段发生的反应为中和反应
D.混合溶液中硫酸和硫酸铜的水平比为1∶1
2、填空题
16.向滴有几滴酚酞的氢氧化钠溶液中滴加稀盐酸至恰好完全反应。

(1)上述反应过程的现象是________。
(2)从微粒的角度说明上图反应的实质是________。
(3)氯原子的结构示意图为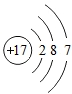 ,下列粒子中和氯原子化学性质一样的粒子是________。
,下列粒子中和氯原子化学性质一样的粒子是________。
A 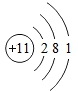 B
B 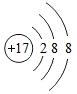 C
C  D
D 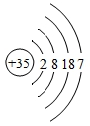
17.浓氨水可以使酚酞溶液变红色。如下图,将烧杯中的酚酞溶液分别倒入A、B两个小烧杯中,另取一个小烧杯C,加入约5mL浓氨水。用一个大烧杯罩住A、C两个小烧杯,烧杯B置于大烧杯外,察看几分钟。
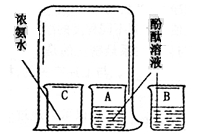
烧杯A中的现象是____________________。烧杯B中的现象是____________________。
依据上述现象可得到的结论是__________________。
18.化学是一把双刃剑,科学地借助它,才能更好地为大家服务.
(1)借助化学转化的办法,可以提升物质的借助率和经济价值.如:用便宜的熟石灰与厨房中的纯碱反应,就能制取作用与功效广.价格高的烧碱,其化学原理是(用化学方程式表示)_______________________________________;
(2)化学商品使用方法不对,也会给人类带来危险.如:2013年5月4日,央视《焦点访谈》曾揭秘我省某地菜田滥用剧毒农药——“神农丹”种植生姜和大葱的违法行为,该农药的化学式为C7H14N2O2S,它由_________种元素组成,其相对分子水平为_________,其中氧、硫两种元素的水平比为_________.
19.构建模型和构建常识互联网是化学学习中要紧的学习技巧,李华同学借助左手构建酸的性质常识互联网,如图所示,请结合图示回答下列问题:
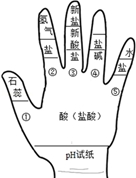
(1)如用湿润的pH试纸测定盐酸的pH,则结果会__________(填“偏大”、“偏小”、“无影响”).
(2)图中①的现象是:__________.
(3)写出一个符合图中③的化学方程式__________.
(4)图中性质④反应的实质是__________.
(5)图中⑤的性质在工业上可用于__________(填作用与功效).
20.化学用语是学化学的基本工具。请从H、O、Na、Cl中选择适合的元素,用化学用语填空:
离子符号:酸中肯定含有些阳离子:____________;
化学式:①生理盐水中的“盐”: ____________;
②人体中含量最多的物质:___________;
化学方程式:写出一个中和反应的方程式:________________________。
3、判断题
21.如图所示,A~G是初中化学容易见到的七种物质。图中“→”表示转化关系,“﹣”表示相互能反应。D、E是组成元素相同的化合物。
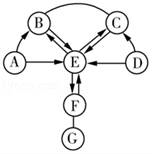
(1)F的化学式是_____;物质A的一种容易见到作用与功效是_____。
(2)D→E反应的化学方程式是_____。
(3)图中涉及的反应中,下列说法正确的是_____。
①G和C之间可能达成相互转换
②只有A→B涉及置换反应
③C→E不止一种渠道
22.A~E均为初中化学容易见到的物质,它们之间的关系如图所示。

“—”表示相互反应
“→”表示反应一步达成
已知A是现在世界上年产量最高的金属;B是胃酸的主要成分;C中金属元素的水平分数为40%,其水溶液呈蓝色,常用来配制农药波尔多液;D是碱;E是盐。
(1)则C的化学式为_____;
(2)E俗称_____其水溶液加入酚酞显_____色
(3)A与B反应的化学方程式为_____;
(4)E转化为D的化学方程式为_____。
4、实验题
23.气体制取是化学实验基本技能之一。
(1)实验室制H2的化学方程式是_____。实验室用固体制O2的化学方程式是_____。
(2)从图中使用4个装置来制取较纯净的CO2气体。①正确的接口顺序从左到右依次为:a接_____;②所选装置有一处明显的错误是_____,B中盛放的液体是_____。

(3)用图中的F装置可以制造十分有趣的“化学喷泉”。将胶头滴管中的NaOH溶液挤进圆底烧瓶时,非常快看到长导管顶端产生“喷泉”现象。烧瓶中发生反应的化学方程式是_____。若将烧瓶内的CO2换成下列四种气体中的_____仍可产生“喷泉”现象(填序号)。
A SO2 B H2 C CO D HCl
5、计算题
24.取2克钢样放在足量的氧气流里灼烧,将生成的气体通入澄清的足量的石灰水中,得到0.084克白色沉淀,则钢样中碳的水平分数是________________。
25.现有149.8g氧化铜与稀硫酸反应所得溶液,向其中逐滴加入NaOH溶液,产生沉淀的水平与所加NaOH溶液的水平关系如图所示,请回答问题:

(1)写出产生沉淀的化学方程式____________。
(2)当加入20g氢氧化钠溶液时,溶液中的溶质是____________。
(3)列出依据已知条件求解参加反应的硫酸铜水平(X)的比率式___________。
(4)反应最后所得溶液的溶质水平分数为____________。
(5)若用水平分数50%的氢氧化钠溶液配制实验所需氢氧化钠溶液,需加水水平为___________g。
参考答案
1.B 2.D 3.B 4.A 5.D 6.B 7.C 8.D 9.D 10.B 11.C 12.C 13.A 14.D 15.A 16.溶液由红色变为无色 氢离子和氢氧根离子结合生成水分子(或![]() 和
和![]() 结合生成
结合生成![]() 分子、
分子、![]() ) CD
) CD
17. 溶液变红 无变化 分子处于运动中
18.(1)Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;(2)五;190;1:
1.
19.(1)偏大;(2)紫色石蕊试液变红
(3)HCl+AgNO3═AgCl↓+HNO3
(4)氢离子和氢氧根离子结合生成水分子
(5)金属除锈
20. H+ NaCl H2O NaOH+HCl=NaCl+H2O
21.Ca(OH)2 除锈 2H2O2![]() 2H2O+O2↑ ①③
2H2O+O2↑ ①③
22.CuSO4 纯碱 红 Fe+2HCl=FeCl2+H2↑ Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
23.Zn+H2SO4═ZnSO4+H2↑; 2KClO3==2KCl+3O2↑(或2KMnO4==K2MnO4+MnO2+O2↑); f、g、c、b、e; 长颈漏斗的下端没伸入液面以下; 浓硫酸; CO2+2NaOH=Na2CO3+H2O; AD
24.0.5%
25.2NaOH+CuSO4= Cu2↓+Na2SO4 CuSO4、Na2SO4 ![]() 或
或![]() 10.65% 36g
10.65% 36g







